Metoda pozytonowej tomografii emisyjnej w medycynie
W nawiązaniu do konferencji Positron Emission Tomography in Research and Diagnostics, która odbędzie się 16 maja 2012 roku zamieszczamy zapowiedziany uprzednio artykuł prof. dr hab. Leszka Królickiego i współpracowników. Należy go traktować jako kontynuację zamieszczonego poprzednio artykułu prof. dr hab. Jerzego Jastrzębskiego, Przewodniczącego Komitetu Organizacyjnego Konferencji
Jacek Zaremba
Dziekan Wydziału Nauk Medycznych PAN
Leszek Królicki, Jolanta Kunikowska, Joanna Mączewska
Zakład Medycyny Nuklearnej, Warszawski Uniwersytet Medyczny
Kontakt: leszek.krolicki@wum.edu.pl
Metoda pozytonowej tomografii emisyjnej w medycynie
Wstęp
Technika PET, obok MRI, jest jedną z najbardziej dynamicznie rozwijających się metod obrazowych w medycynie. Jej rozwój zależy od postępów w dziedzinie zarówno technologii, jak i w zakresie radiofarmacji. Historia tej metody jest długa. Pierwsze prace dotyczące tej metody pochodzą z lat pięćdziesiątych XX wieku. Koncepcję tomografii emisyjnej i transmisyjnej zostały przedstawione przez Dawid E Kuhl, Luke Chapman i Roy Edwards. Ich koncepcje zostały wykorzystane w konstrukcji pierwszych gamma kamer. Metoda ta była następnie rozwijana przez M Ter-Pogossiana'a i M Phelps'a. Pierwsze badania kliniczne były przeprowadzone na początku lat pięćdziesiątych przez G Brownell'a, i W Sweet'a. Autorzy ci wykorzystali radiofarmaceutyki pozytonowe i system dwóch sond scyntylacyjnych do obrazowania guzów mózgu, wykazując, że rozdzielczość proponowanej metody jest znacznie lepsza niż klasycznej scyntygrafii mózgu po podaniu znakowanych 131I- albumin. W 1961 roku J Robertson i wsp. skonstruowali pierwszy skaner planarny do badań PET. Jednak na szerokie zastosowania kliniczne oczekiwano do lat osiemdziesiątych i dziewięćdziesiątych.
Przełomowymi wydarzeniami w rozwoju PET było wprowadzenie wielorzędowych gamma kamer, a następnie aparatów hybrydowych PET-CT. Drugim kamieniem milowym było wprowadzenie znakowanej fluorem-18 deoxyglukozy (18FDG) jako uniwersalnego znacznika, szczególnie w badaniach onkologicznych, ale również kardiologicznych i neurologicznych.
Obecnie do wymagających podkreślenia rozwiązań technologicznych należy wprowadzenie techniki „time of flight", a przede wszystkim techniki hybrydowej PET-MRI.
W zakresie radiofarmacji, obok 18FDG, stosowanych jest obecnie kilkanaście nowych radiofarmaceutyków pozwalających na ocenę metabolizmu aminokwasów, ekspresji szeregu układów receptorowych, apoptozy, angiogenezy, chorób zwyrodnieniowych mózgu (amyloid), stopnia niedotlenienia, i inne.
Technika PET jest podstawową metodą pozwalającą na tzw. obrazowanie molekularne. Jej niewątpliwą zaletą jest możliwość podania śladowej dawki radiofarmaceutyku, celem uzyskania informacji o procesach molekularnych na poziomie komórkowym. Dawka ta jest tak mała, że znacznik nie wpływa na naturalnie przebiegające procesy biochemiczne. Metoda PET pozwala na obrazowanie zmian w stężeniu badanego związku chemicznego na poziomie zaledwie 10 -11 mola. W przypadku nawet zaawansowanych technologii MRI, stężenie związku chemicznego musi sięgać co najmniej 10 -4 mola.
Historia i stan obecny w Polsce
Historia PET w Polsce jest również długa. W tym miejscu należy przypomnieć wywiad z prof. W Grabanem zamieszczonym w Przeglądzie Technicznym w 1983 roku „ Tomografia, ale jaka?". W latach dziewięćdziesiątych kilkukrotnie środowisko medyczne w Polsce występowało do Komitetu Badań Naukowych o realizację tego projektu. W 2001 roku został złożony grand inwestycyjny uwzględniający zakup aparatu PET. W tamtych czasach jednak fundusze na naukę i opiekę zdrowotną były na tyle małe, że realizacja projektu była niemożliwa; realizacja programu pochłonęłaby fundusze co najmniej trzech wydziałów naukowych KBN. Należy wspomnieć również o licznych wystąpieniach do Ministerstwa Zdrowia na przełomie lat 90 i 2000. W 2002 roku na zlecenie PAN Wydziału Nauk Medycznych została przygotowana ekspertyza „PRZEWIDYWANE KOSZTY I ZYSKI WPROWADZENIA TECHNIKI PET W POLSCE W WYBRANYCH JEDNOSTKACH CHOROBOWYCH" (Prof. dr hab. med. Leszek Królicki. Dr med. Anna Teresińska).
Mimo narastającej liczby publikacji wskazujących na wymierne korzyści finansowe wprowadzenia techniki PET dla ochrony zdrowia, wystąpienia te nie spotkały się z zainteresowaniem. Przełom nastąpił w roku 2002. W tym roku Dyrektor Regionalnego Centrum Onkologicznego w Bydgoszczy dr Zbigniew Pawłowicz podjął decyzję o zaciągnięciu komercyjnego kredytu na zakup aparatu PET i cyklotronu. Była to samodzielna decyzja – bez wsparcia ze strony władz centralnych. Ośrodek został otwarty w roku 2003. Realizacja tego projektu okazała się sukcesem nie tylko w sferze medycyny, ale również medialnym. Doświadczenia ośrodka bydgoskiego dowiodły, że metoda ta jest niezwykle potrzebna, a Polska przestała być białą plamą na mapie Europy. Decyzja o zakupie nie tylko aparatu PET, ale również cyklotronu i linii produkcyjnej do syntezy radiofarmaceutyków podyktowana była brakiem w tamtym czasie dostępu do radiofarmaceutyków na terenie Polski. Doświadczenia te przekonały również Ministerstwo Zdrowia, że problem powinien zostać rozwiązany. W roku 2005 podjęto decyzję o realizacji projektu nazwanego „Sieć PET/CT w Polsce". W ramach tego projektu przeznaczono fundusze na zakup 6 aparatów PET-CT. Program został zrealizowany w ciągu 4 lat. Oddano ośrodki PET w Instytucie Onkologii w Gliwicach (2006 r), Świętokrzyskim Centrum Onkologii w Kielcach, Warszawskim Uniwersytecie Medycznym i Instytucie Onkologii w Warszawie, Uniwersytecie Medycznym w Gdańsku, Wielkopolskim Centrum Onkologii w Poznaniu.
Równolegle do realizacji programu ministerialnego zaczęły powstawać kolejne ośrodki PET. Pierwszym tego typu ośrodkiem są pracownie zorganizowane przez prywatną instytucję Euromedic (Warszawa – 2009, Wrocław – 2010, Poznań - 2010). Podobnie powstał w roku 2011 ośrodek w Olsztynie. Dzięki funduszom unijnym przyznanym firmie Voxel powstały ośrodki w Łodzi i Krakowie. Fundusze unijne pozwolą również na organizację ośrodków w Chorzowie (projekt zrealizowany w roku 2011), Lublinie, Krakowie.
Rozwijająca się baza producentów radiofarmaceutyków w Austrii i Niemczech umożliwiła i umożliwia dostęp polskich ośrodków do radiofarmaceutyków. Pierwsza rejestracja 18FDG w Polsce została przeprowadzona w roku 2007 przez austriacką firmę IASON.W roku 2009 rejestracji dokonała firma Ziegler /Eckert. Równolegle do działalności producentów zagranicznych (którzy transportują radiofarmaceutyki z Austrii czy Niemiec) powstał projekt wsparcia polskich ośrodków produkcyjnych (projekt ministerialny – 2010-2011). W ramach tego projektu wsparto działania ośrodka w Gliwicach i Bydgoszczy. W lutym 2012 otwarto linię produkcyjną w Kielcach (IASON). Plany otwarcia na terenie Polski linii produkcyjnych mają również inne firmy zagraniczne. Na osobne omówienie zasługuje inicjatywa warszawska. W ramach konsorcjum licznych jednostek medycznych i naukowo badawczych już na początku lat 2000 powstał projekt utworzenia ośrodka produkcji radioizotopów dla celów PET na terenie Uniwersytetu Warszawskiego (patrz artykuł Profesora Jerzego Jastrzębskiego).
W sumie w Polsce pracuje obecnie 14 ośrodków PET/CT wyposażonych w 16 aparatów. Planowane jest otwarcie kolejnych placówek – w Lublinie, Krakowie (2 ośrodki), Katowicach.
Gdy przygotowywane były pierwsze plany rozwoju techniki PET zakładano, że w Polsce powinno być 6-7 ośrodków, a zapotrzebowanie na badania będzie wynosiło 8 -12 000/rocznie. Już od kilku lat wykonywanych jest około 20 000 badań/rocznie.
Czy obecna liczba ośrodków i badań jest wystarczająca? Pytanie to jest trudne i odpowiedź na nie jest weryfikowana niemal na bieżąco. W roku 2004 ukazała się publikacja "Requirements for clinical PET: comparisons within Europe." (Bedford M., Maisey MN. (Eur J Nucl Med Mol Imaging. 2004;31:208-21). Grupa niezależnych ekspertów, biorąc pod uwagę epidemiologię schorzeń nowotworowych w poszczególnych krajach europejskich i ówczesne wskazania do PET wyraziła opinię, że w Polsce powinno działać 28 ośrodków, każdy wykonujący około 2000 badań/rocznie. Liczba badań i ośrodków zależy również od nowych wskazań do PET. Wskazania te rozszerzają się. Bardzo ciekawym rozwiązaniem okazał się model amerykański. W Stanach Zjednoczonych określono podstawowe wskazania do badania PET, natomiast równolegle otwarto możliwość dalszych badań. W Polsce po niemal 10 latach doczekaliśmy się również weryfikacji uprzednich wskazań. Co więcej uznano, że obok podstawowego radiofarmaceutyku jakim jest nadal 18FDG należy wprowadzać nowe znaczniki NaF do badania kości, czy znakowaną cholinę do badania guzów wątroby, a przede wszystkim guzów gruczołu krokowego (wskazaniem jest diagnostyka wznowy procesu nowotworowego po uprzednim leczeniu).
Podstawy fizyczne metody PET
Metoda PET polega na zastosowaniu krótkożyjących pierwiastków promieniotwórczych emitujących pozytony. Pozytony są emitowane przez jądro atomowe, ich charakterystyka jest bardzo zbliżona do elektronu, natomiast podstawową różnicą jest ładunek elektryczny – są one cząsteczkami o dodatnim ładunku elektrycznym. Spełniają więc definicję antymaterii. Pozyton, po emisji, przemieszcza się w środowisku na odległość nie większą niż kilka milimetrów, ulegając reakcji z elektronem napotkanego atomu. W wyniku reakcji z elektronem zachodzi zjawisko anihilacji, tzn. zamiany dwóch cząsteczek materii w dwie fale elektromagnetyczne (fale gamma). Charakteryzują się one dwiema szczególnymi właściwościami: ich energia jest ściśle określona i wynosi 511keV, biegną one w dwóch przeciwnych kierunkach (antyrównolegle). Pośrednim sposobem na pomiar promieniowania pozytonowego jest więc rejestracja tylko promieni gamma o określonej energii, które w tym samym czasie są rejestrowane przez układ detektorów. Przedział czasu, w którym dwa detektory powinny zarejestrować impulsy określa się mianem okienka czasowego. Obecne urządzenia pozwalają na pomiar z dokładnością kilku nanosekund. Metoda ta nazywana jest techniką koincydencji. Układ detektorów gamma kamery PET składa się z kilku tysięcy kryształów scyntylacyjnych oraz fotopowielaczy.
Promieniowanie gamma podlega reakcji z materią. Reakcje te prowadzą do pogorszenia jakości ostatecznego obrazu scyntygraficznego. Należą do nich zjawisko rozproszenia i pochłaniania. Z tego względu konieczna jest odpowiednia korekcja tych zjawisk. Zjawisko rozproszenia polega na interakcji promienia gamma z napotkanym atomem i przekazania mu części energii. Prowadzi to do zmiany kierunku dalszego biegu promienia i zmniejszenia jego energii. Rejestracja promieniowania rozproszonego niesie ze sobą fałszywą informację o miejscu zaistnienia anihilacji. Celem ograniczenia udziału promieniowania rozproszonego stosuje się tzw. okno energetyczne. Jak zaznaczono, rozproszony promień charakteryzuje się mniejszą energią. Dzięki temu nie jest on rejestrowany przez układ komputerowy. Drugim zjawiskiem ograniczającym rejestrację jest zjawisko pochłaniania. Polega ono na oddaniu całej energii napotkanemu atomowi. Promień gamma nie dociera więc do detektora i nie jest rejestrowany przez układ komputerowy. Stopień pochłaniania zależy od gęstości otoczenia. Gęstość otoczenia można dokładnie określić na podstawie tomografii transmisyjnej. W poprzednich aparatach umieszczano źródła promieniowania w obudowie gamma kamery i wykonywano skan badanego odcinka ciała. Rolę tę może spełniać również badanie CT. Uzyskując więc rozkład gęstości tkanek możliwe jest wprowadzenie odpowiedniego algorytmu korygującego to zjawisko. Przesłanka ta była podstawą wprowadzenia urządzeń typu PET-CT. Pierwszy skaner PET-CT został wprowadzony w roku 2001. Wprowadzenie aparatów hybrydowych PET-CT pozwala nie tylko na uzyskiwanie znacznie dokładniejszych obrazów PET (dzięki korekcji pochłaniania). Umożliwia również dokładną lokalizację ognisk zwiększonej radioaktywności (dzięki obrazowi CT). W praktyce, podstawową zaletą badania hybrydowego okazało się zwiększenie swoistości uzyskiwanych wyników: badanie PET-CT umożliwia różnicowanie między ogniskami fizjologicznego i patologicznego gromadzenia znacznika. Wprowadzenie tej metody wymagało opracowania odpowiednich protokołów badań. Należy przede wszystkim zaznaczyć, że badanie CT w aparacie PET-CT może być wykonywane w dwóch opcjach – tylko celem korekcji zjawiska pochłaniania (dawka promieniowania pochłoniętego przez badanego jest znacznie mniejsza, obraz CT nie spełnia jednak wymogów badania diagnostycznego) oraz w celu korekcji obrazu PET i uzyskania diagnostycznego obrazu CT. W tej drugiej opcji niejednokrotnie konieczne jest podanie środka kontrastowego. Środek kontrastowy z kolei może być przyczyną artefaktów na obrazach PET (nieprawidłowa korekcja pochłaniania spowodowana wpływem kontrastu). Dlatego należy niezależnie analizować obrazy bez i po korekcji pochłaniania.
Innym ograniczeniem badania fuzyjnego są artefakty ruchowe (głównie oddechowe). Badanie PET-CT odbywa się sekwencyjnie – początkowo wykonywane jest CT, a następnie badanie PET. Co więcej, czas trwania obu badań jest różny. Jest to przyczyną pewnych niedokładności w nałożeniu (fuzji) obrazów CT i PET spowodowanych głównie przemieszczaniem się narządów w trakcie cyklu oddechowego. Problem ten jest rozwiązywany z zastosowaniem techniki bramkowania; rejestracja danych jest korelowana z cyklem oddechowym (oba badania wykonywane są w trakcie tej samej fazy cyklu oddechowego).
Radiofarmaceutyki
Podstawą medycyny nuklearnej jest podanie badanemu substancji podlegającej określonym przemianom metabolicznym. Zwiększenie lub zmniejszenie gromadzenia znacznika wskazuje na aktywność ściśle określonego procesu metabolicznego. Substancję taką, znakowaną radioizotopem, nazywa się radiofarmaceutykiem. Obecnie stosowanych jest w badaniach klinicznych i naukowych kilkadziesiąt radiofarmaceutyków. Substancje te mają bardzo zróżnicowany charakter: należą do nich proste związki, takie jak NaF ( wbudowywany do tkanki kostnej proporcjonalnie do nasilenia obrotu kostnego), RbCl (analog potasu), cholina, aminokwasy oraz złożone peptydy czy białka, pozwalające na badania ekspresji układów receptorowych błon komórkowych.
Podstawowe znaczenie w diagnostyce onkologicznej odgrywa obecnie ocena procesów metabolicznych dla glukozy. W roku 1924 Warburg wykazał, że komórki nowotworowe charakteryzują się szczególnym fenotypem - innym torem przemiany glukozy; glukoza w komórkach nowotworowych jest metabolizowana głównie na drodze beztlenowej. Mechanizm ten jest mało wydajny – z jednej cząsteczki glukozy powstają zaledwie dwie cząsteczki ATP (w przemianach tlenowych – około 30 cząsteczek). Z tego względu zapotrzebowanie komórek nowotworowych na glukozę jest wielokrotnie większe niż komórek prawidłowych (zjawisko Warburga). Konsekwencją tego zjawiska jest znacznie zwiększona aktywność jednego z mechanizmów transportujących glukozę przez błonę komórkową – Glut 1. Mechanizm ten ulega zwiększonej aktywności szczególnie w stanach niedotlenienia. Tak więc niedotlenienie (typowo obserwowane w obrębie szybko rozwijających się guzów) prowadzi do zwiększonego transportu glukozy i nasilenia przemian beztlenowych, w wyniku czego następuje zakwaszenie środowiska zewnątrzkomórkowego tkanki nowotworowej. Zakwaszenie z kolei prowadzi do szeregu zjawisk typowych dla rozwoju nowotworu:
1. produkcja czynników wzrostowych,
2. niewrażliwość na czynniki hamujące wzrost,
3. zahamowanie apoptozy,
4. replikacja, angiogeneza,
5. inwazja,
6. odporność na obronne mechanizmy immunologiczne.
Zastosowanie znakowanej glukozy w badaniach PET jest niemożliwe ze względu na jej szybką przemianę. Kamieniem milowym było wykazanie, że bliskim analogiem glukozy jest deoxyglukoza. Jest ona transportowana przez te same mechanizmy transportujące do przestrzeni wewnątrzkomórkowej i ulega fosforylacji w pierwszej reakcji cyklu Krebsa (w wyniku działania hexokinazy). Natomiast produkt fosforylacji (6-deoxy-glukozo-fosforan) nie ulega dalszym istotnym przemianom i gromadzi się w komórce. Co więcej, deoxyglukoza może być łatwo znakowana radioaktywnym fluorem – emiterem promieniowania pozytonowego (18F). Tak więc mierzona radioaktywność 18FDG jest wskaźnikiem procesów metabolicznych dla glukozy (a ściślej, jest wskaźnikiem aktywności mechanizmów transportujących glukozę i aktywności hexokinazy). Obecnie niemal 90% badań techniką PET wykonuje się stosując 18FDG. Radiofarmaceutyk ten nie jest swoistym znacznikiem onkofilnym – jest gromadzony również przez inne tkanki wykazujące zwiększony metabolizm dla glukozy (np. komórki procesu zapalnego, brązowa tkanka tłuszczowa, mięśnie).
Do nowotworów wykazujących opisany fenotyp należy większość raków okolicy głowy i szyi, czerniaki, chłoniaki, raki płuc, jelita grubego, mięsaki, raki trzustki, jajników, niskozróżnicowane glejaki. Należy również wymienić nasieniaki, raki endometrium, żołądka i dróg żółciowych. Nie wszystkie nowotwory wykazują jednak zjawisko Warburga. Czułość badania 18FDG-PET w przypadku raka prostaty, guzów neuroendokrynnych (NET), czy raka pierwotnego wątroby jest na tyle mała (rzędu 30-50%), że metoda ta nie jest polecana.
Jak zaznaczono, zwiększone gromadzenie 18FDG może występować również w zmianach łagodnych (głównie ogniskach zapalnych). Charakteryzuje się ono jednak odmienną dynamiką: wykazano, że gromadzenie 18FDG w guzach nowotworowych ulega w czasie dalszemu wzrostowi, natomiast w zmianach łagodnych ma tendencję do spadku. Stąd też, w wybranych przypadkach, badanie PET może być wykonywane dwukrotnie – po 1 godzinie oraz po 2-3 godzinach. Uważa się, że protokół ten pozwala na uzyskanie lepszej swoistości.
Kolejnym procesem biologicznym możliwym do oceny w badaniu PET jest ocena potencjału proliferacyjnego guza. W tym celu wykorzystuje się znakowaną 11C lub 18F tymidynę (FLT). Tymidyna jest transportowana do komórek, a następnie ulega procesowi fosforylacji w wyniku reakcji z kinazą tymidynową typu 1 (TK 1) i jest wykorzystywana do syntezy DNA. Mimo, iż tylko część znakowanej tymidyny zostaje wbudowana do DNA, to jednak gromadzenie tego znacznika jest proporcjonalne do innych wskaźników proliferacji (np. do wartości Ki-67). Gromadzenie tymidyny jest proporcjonalne do aktywności TK 1 i frakcji komórek w fazie S.
Badania PET pozwalają na ocenę stopnia niedotlenienia guza nowotworowego (stopnia hipoksji). Stan niedotlenienia zmniejsza wrażliwość guza nowotworowego na radioterapię i niektóre chemioterapeutyki. Ma też znaczenie prognostyczne. Znacznikiem wykazującym zdolność do gromadzenia się w tkankach niedokrwiennych jest fluoro-misonidazol. Szereg obserwacji wskazuje, że badanie PET z zastosowaniem tego znacznika będzie coraz szerzej stosowane – zwłaszcza w planowaniu radioterapii.
Coraz większe zainteresowanie budzi zastosowanie znaczników obrazujących procesy metaboliczne choliny. Wiąże się to z wynikami badań MRS wskazującymi, że szereg nowotworów wykazuje zwiększone stężenie tej substancji (rak prostaty, rak wątrobowo-komórkowy, nowotwory układu nerwowego). Cholina jest składnikiem fosfatydylocholiny budującej fosfolipidy błon komórkowych. Zwiększone gromadzenie analogów choliny wskazuje więc na zwiększony potencjał proliferacyjny guza nowotworowego.
Jednym z fenotypów nowotworowych jest również zwiększona ekspresja niektórych układów receptorowych. Typowym przykładem są guzy neuroendokrynne (NET) charakteryzujące się zwiększoną ekspresją receptorów somatostatynowych. Ocena tego układu receptorowego możliwa jest z zastosowaniem analogów somatostatyny znakowanych 68Ga (68Ga-DOTA-TATE, 68Ga-DOTA-TOC). Badania PET-CT wykazują większą czułość i swoistość niż badania z zastosowaniem konwencjonalnych technik diagnostycznych, szczególnie w rozpoznawaniu ognisk przerzutowych. Czułość badania z zastosowaniem pochodnych somatostatyny wynosi 82%, z zastosowaniem 18FDG – 66%, Natomiast czułość obu badań – 92%.
Powyżej przedstawiono tylko kilka przykładów radiofarmaceutyków stosowanych obecnie w badaniach PET. Dalszy rozwój tej metody opiera się przede wszystkim na wprowadzaniu nowych znaczników obrazujących różne zaburzenia procesów metabolicznych w komórkach nowotworowych.
Wybrane wskazania kliniczne do badań PET
Badanie PET w onkologii wykorzystywane jest w różnych sytuacjach klinicznych:
1. Poszukiwanie ogniska pierwotnego – niejednokrotnie rozpoznanie choroby nowotworowej opiera się na stwierdzeniu ogniska przerzutowego. Nieznane jest jednak położenie ogniska pierwotnego. W tym zastosowaniu badanie PET wykazuje znacznie większą czułość niż inne techniki diagnostyczne. Podstawową zaletą badania jest możliwość wykonania scyntygrafii całego ciała, bez dodatkowego narażenia na promieniowanie jonizujące.
2. Najczęściej w onkologii badanie wykonuje się celem określenia stopnia zaawansowania choroby. Znane jest ognisko pierwotne, natomiast niepewne jest określenie, czy występują ogniska przerzutowe do węzłów chłonnych i innych narządów. Od właściwego określenia stopnia zaawansowania choroby zależy z kolei sposób postępowania: brak zmian przerzutowych (lub ich obecność tylko w węzłach regionalnych) wskazuje na możliwość skutecznego leczenia operacyjnego; rozsiany proces chorobowy wskazuje natomiast, że właściwym postępowaniem jest zastosowanie leczenia systemowego. W tym wskazaniu technika PET przewyższa inne techniki obrazowe i zmienia plan postępowania medycznego nawet w 10-20% przypadków.
3. Kontrola leczenia. Jest to ważne wskazanie do badania PET. Należy pamiętać, że po operacji czy radioterapii powstające zmiany morfologiczne (blizny, zwłóknienia) mogą sugerować obecność choroby nowotworowej. Badanie PET, oceniając procesy metaboliczne, pozwala wówczas na różnicowanie między pozostałym procesem chorobowym a innymi zmianami
4. Szereg obserwacji wskazuje, że technika PET umożliwia monitorowanie chemioterapii. Wykazano, że badanie wykonane po 2-3 kursach chemioterapii pozwala na określenie, czy zastosowane leczenie może okazać się jest skuteczne – zmniejszenie się gromadzenia 18FDG (a więc spadek poziomu przemian metabolicznych) sugeruje właściwą odpowiedź terapeutyczną. Badanie to ma szczególną wartość prognostyczną. Inne metody obrazowe opierają się przede wszystkim na ocenie wielkości ogniska, a nie na efektach metabolicznych. Z tego względu weryfikacji uległy kryteria odpowiedzi na chemioterapię. Coraz częściej tzw. kryteria RECIST zastępowane są kryteriami PRECIS.
Ze względu na różnorodną biologię procesów nowotworowych technika PET wykorzystywana jest w różnym stopniu. Doświadczenie kliniczne wskazuje, kiedy badanie to odgrywa znaczenie kliniczne.
Rak płuc
Badanie PET odgrywa obecnie istotną rolę we wstępnej ocenie stopnia zaawansowania (staging) raka niedrobnokomórkowego: pozwala ono na rozpoznanie zmian przerzutowych do węzłów chłonnych i przerzutów odległych. Informacje te są podstawą wyboru sposobu leczenia. PET uwidacznia również ognisko pierwotne. Jest ono jednak oceniane na podstawie przede wszystkim CT po podaniu kontrastu, ze względu na lepszą rozdzielczość tej metody oraz możliwość uwidocznienia szczegółów anatomicznych koniecznych do planowania leczenia operacyjnego. Czułość i swoistość PET w ocenie węzłów chłonnych śródpiersia wynosi odpowiednio 83% i 92%, natomiast CT - 52% i 78%. Ponieważ stosowane techniki obrazowania nie pozwalają na jednoznaczne wykluczenie ognisk przerzutowych do węzłów chłonnych śródpiersia, w przypadku wyniku ujemnego, wskazana jest mediastinoskopia. Badanie PET wykazuje również większą czułość i swoistość w ocenie przerzutów odległych (do układu kostnego, nadnerczy, węzłów chłonnych poza śródpiersiem) w porównaniu do badania CT. U 24% chorych PET uwidacznia ogniska przerzutowe niewidoczne w innych klasycznych badaniach obrazowych. Badanie PET jest stosowane również w ocenie prognozy i kontroli leczenia. Odpowiedź na leczenie chemio- radioterapeutyczne wiąże się z wyraźnym spadkiem gromadzenia znacznika w obrębie uprzednio opisywanych ognisk zwiększonego gromadzenia 18FDG. PET pozwala na znacznie wcześniejsze niż CT rozpoznanie wznowy po zakończonym leczeniu operacyjnym, radio- i chemioterapii.
Badanie jest stosowane również w ocenie charakteru pojedynczego guza płuc (SPN). Około 50% pojedynczych guzów ma charakter złośliwy. Gromadzenie 18FDG w obrębie guza wskazuje na możliwość procesu rozrostowego. Badanie w tym zastosowaniu wykazuje czułość rzędu ponad 90%. Swoistość badania jest jednak mała – około 50%. Również guzy o charakterze zapalnym (ziarniniaki, gruźliczak, sarkoidoza) wykazują gromadzenie znacznika. Guzy nie wykazujące gromadzenia znacznika mogą być dalej kontrolowane, guzy wykazujące gromadzenie 18FDG wymagają zastosowania inwazyjnych metod diagnostycznych. Należy pamiętać jednak, że rak oskrzelikowo-pęcherzykowy może wykazywać niskie gromadzenie 18FDG.
Rak jelita grubego
Ponieważ klasyczne metody diagnostyczne są wystarczająco czułe, PET nie jest badaniem stosowanym w diagnostyce wstępnej raka jelita grubego. Odgrywa natomiast podstawowe znaczenie w ocenie zajęcia okolicznych węzłów chłonnych oraz przerzutów odległych (przede wszystkim do wątroby). W chwili kwalifikacji do leczenia operacyjnego, ogniska przerzutowe do wątroby występują aż u 10-25% chorych. Czułość i swoistość dla PET wynosi odpowiednio 88% i 100%, natomiast dla CT 38% i 97%.
PET stosowany jest również w diagnostyce miejscowej wznowy procesu nowotworowego. W tym zastosowaniu badanie to jest szczególnie przydatne: pozwala na różnicowanie między zmianami pooperacyjnymi a wznową. Wznowa procesu nowotworowego występuje u około 25% chorych, u 20 % ma charakter miejscowy i może być skutecznie leczona operacyjnie. Wynik badania PET zmienia decyzje terapeutyczne u około 18-43% w tej grupie chorych.
Czerniak
U chorych na czerniaka PET jest stosowany do oceny zmian przerzutowych. Znaczenie metody zależy jednak od stopnia zaawansowania choroby. W stadium I, ze względu na długi spodziewany czas przeżycia, rola badania jest ograniczona, jego wynik nie odgrywa istotnego znaczenia w postępowaniu klinicznym. Podobnie w stadium IV – gdy spodziewany czas przeżycia jest krótki. W stadium II główne znaczenie ma badanie węzła wartowniczego. Rozdzielczość PET jest zbyt mała, aby zastąpić tą procedurę. Natomiast w stadium III ocena występowania odległych zmian przerzutowych odgrywa istotne znaczenie w wyborze sposobu leczenia. W grupie tej PET jest badaniem z wyboru.
Chłoniaki
PET jest szczególnie użyteczną metodą w diagnostyce chłoniaków. Wynika to z dwóch czynników: duża grupa chłoniaków wykazuje zwiększone gromadzenie 18FDG, ważnym czynnikiem decydującym o stopniu zaawansowania jest lokalizacja ognisk chorobowych, stąd też badanie całego ciała (stosowane rutynowo w PET) jest krytyczne dla oceny klinicznej. PET jest stosowany zarówno w diagnostyce wstępnej, jak i ocenie stopnia zaawansowania (staging), ocenie stopnia zaawansowania po leczeniu (re-staging), odpowiedzi na leczenie. W interpretacji wyniku badania należy uwzględnić typ chłoniaka. Choroba Hodgkina, rozlany chłoniak wielkokomórkowy (DLBCL), chłoniak grudkowy i chłoniak z komórek płaszcza wykazują znacznie zwiększone gromadzenie 18FDG. Chłoniak z obwodowych komórek T i chłoniak strefy brzeżnej wykazują z kolei umiarkowane gromadzenie 18FDG. Badanie PET w porównaniu do CT jest szczególnie użyteczne w diagnostyce zmian poza węzłowych i ognisk w śledzionie. Ponieważ stopień gromadzenia 18FDG koreluje z typem histologicznym chłoniaka, wynik badania ma znaczenie prognostyczne. Ujemny wynik badania PET 2-3 miesiące po zakończeniu leczenia wskazuje na bardzo dobrą odpowiedź na leczenie i dobrą prognozę. Obecność ognisk zwiększonego gromadzenia sugeruje możliwość nawrotu choroby. W tym zastosowaniu PET jest lepszym wskaźnikiem niż ocena wielkości węzłów chłonnych w badaniu CT. Badanie PET jest stosowane także w trakcie chemioterapii. Wynik badania wykonanego po pierwszym/drugim kursie leczenia wskazujący na spadek gromadzenia znacznika sugeruje skuteczny dobór chemioterapeutyków.
Raki głowy i szyi
Najczęstszym rakiem tej okolicy jest rak płaskonabłonkowy. W diagnostyce raka płaskonabłonkowego badanie PET jest stosowane zarówno w celu określenia wstępnego stopnia zaawansowania, jak i w monitorowaniu leczenia. PET jest natomiast badaniem uzupełniającym w ocenie cechy T (charakterystyka guza pierwotnego). W tym zastosowaniu badania tomografii rezonansu magnetycznego (MRI) i CT po podaniu kontrastu wykazują przewagę, pozwalając na lepszą ocenę zasięgu choroby i szczegółów anatomicznych koniecznych do planowania leczenia operacyjnego. Obecnie stosowana metoda PET-CT, łączy zalety obu metod diagnostycznych. Zaletą PET jest możliwość znacznie dokładniejszej oceny zmian przerzutowych do okolicznych węzłów chłonnych oraz przerzutów odległych. Ogniska przerzutowe stwierdzane tylko w badaniu PET występują u około 10% chorych na raka płaskonabłonkowego określanego wstępnie jako zmiana tylko miejscowa. Należy podkreślić, że PET, podobnie jak CT czy MRI jest metodą stosunkowo mało czułą w ocenie zmian przerzutowych do niewyczuwalnych węzłów chłonnych. Wiąże się to z ograniczoną rozdzielczością (rzędu około 5 mm) obrazów. Pewniejszą metodą jest ocena węzła wartowniczego, czy badanie hist.-pat. usuniętych węzłów chłonnych. U chorych, u których stwierdza się zajęcie węzłów chłonnych, wynik badania decyduje o zasięgu operacji czy radioterapii. Badanie PET wykazuje również większą czułość niż CT czy MRI w ocenie wznowy choroby nowotworowej.
PET jest stosowana także w diagnostyce raka tarczycy. Badanie jest uzasadnione u chorych po leczeniu radykalnym, jeśli scyntygrafia całego ciała po podaniu 131I nie wykazuje zmian chorobowych, natomiast stwierdza się wyraźnie zwiększone stężenie w surowicy krwi tyreoglobuliny (marker dla zróżnicowanego raka tarczycy).
Rak gruczołu piersiowego
Badanie PET w diagnostyce ogniska pierwotnego traktowane jest jako metoda uzupełniająca: u chorych bez wyczuwalnego guzka, jeśli wynik mammografii jest niejednoznaczny oraz w tzw. „gęstym" gruczole. Związane jest to z ograniczoną rozdzielczością metody i zróżnicowanym charakterem zmian metabolicznych w różnych typach nowotworów. PET jest natomiast metodą polecaną w diagnostyce ognisk przerzutowych, zwłaszcza odległych. PET jest również metodą czulszą w ocenie zajęcia węzłów chłonnych pachowych. Prawidłowy wynik badania nie wyklucza jednak konieczności oceny węzłów wartowniczych: PET nie pozwala na ocenę ognisk mikro-przerzutów. Podkreśla się natomiast znaczenie PET w diagnostyce wznowy choroby nowotworowej. Jednym z kierunków rozwoju techniki PET jest konstrukcja gamma kamer dedykowanych diagnostyce poszczególnych narządów. Pierwszy skaner tego typu został skonstruowany do badania gruczołów piersiowych. Czułość badania (mammo-PET) jest znacznie lepsza, rozdzielczość uzyskiwanych obrazów wynosi nawet 2-3 milimetry.
Inne zastosowania techniki PET
Przedstawione wskazania do badania PET dotyczą zastosowania 18FDG. Obecnie coraz częściej stosowane są również inne znaczniki. Należy podkreślić znaczenie badania PET po podaniu znakowanych 68Ga-analogów somatostatyny w diagnostyce guzów typu neuroendokrynnego (NET). Czułość i swoistość tej metody są znacznie większe niż innych metod diagnostycznych.
Badanie PET po podaniu fluorku sodu (18F-NaF) stosowane jest w diagnostyce zmian przerzutowych do układu kostnego. Czułość tego badania jest znacznie większa niż klasycznej scyntygrafii z zastosowaniem fosfonianów znakowanych 99mTc (99mTc-MDP).
Innym radiofarmaceutykiem wykorzystywanym w technice PET jest fluorocholina (18F-cholina). Jak zaznaczono powyżej, badanie to okazało się skuteczne w diagnostyce raka gruczołu krokowego i raka pierwotnego wątroby.
Zastosowanie techniki PET w diagnostyce padaczki
Padaczka jest najczęstszą chorobą układu nerwowego. Na padaczkę choruje około 1% osób, czyli w Polsce cierpi na nią ok. 400 tysięcy chorych. Padaczka oporna na leczenie występuje u ok 1/3 chorych, w tej grupie skuteczne może być leczenie operacyjne.
Resekcja chirurgiczna jest szczególnie wskazana u chorych z ogniskiem padaczkorodnym zlokalizowanym w przyśrodkowej części płata skroniowego (najczęstsza postać padaczki u dorosłych). Ocena przedoperacyjna poza historią napadów, badaniem neurologicznym i rejestracją napadów EEG obejmuje badania obrazowe, takie jak badanie MR oraz badania radioizotopowe.
Najczęściej stosowanym badaniem izotopowym jest badanie PET z 18F FDG wykonywane w fazie międzynapadowej. W ognisku padaczkorodnym w związku z utratą neuronów, procesami hamowania oraz zmniejszeniem gęstości synaptycznej w badaniu PET z FDG widoczny jest obszar obniżonego metabolizmu. Jednak obszar hipometabolizmu rozciąga się wokół ogniska padaczkordnego i jest od niego znacznie większy. Stąd badanie to bardziej służy do lateralizacji niż precyzyjnej lokalizacji ogniska wywołującego napady padaczkowe, szczególnie u chorych z padaczką skroniową. Badanie PET ma również znaczenie rokownicze - u części chorych obserwuje się hipometabolizm również w obrębie drugiego płata skroniowego. W tej grupie chorych istnieje wysokie ryzyko, że napady padaczkowe będą występowały również po operacji.
Podsumowanie
Historia techniki PET jest przykładem szerokiej współpracy między fizykami, biologami i lekarzami. Również dalszy rozwój tej metody wymaga ścisłej współpracy między przedstawicielami różnych dziedzin nauki. Jej wprowadzenie pozwoliło na praktyczne zastosowania technik z zakresu obrazowania molekularnego. Nazwa „Medycyna Nuklearna" wiązała się z fizyką, promieniowaniem emitowanych przez jądra atomów. Obecnie wiąże się z możliwością nieinwazyjnego obrazowania procesów metabolicznych zachodzących na poziomie jądra komórkowego.
| RYC 1 Badanie PET/CT po podaniu 18 FDG u pacjenta z chłoniakiem Hodgkina. Badanie wykonano w celu wstępnej oceny stopnia zaawansowania. Widoczne są liczne aktywne metabolicznie węzły chłonne szyjne oraz śródpiersiowe |
|
| A Badanie PET | 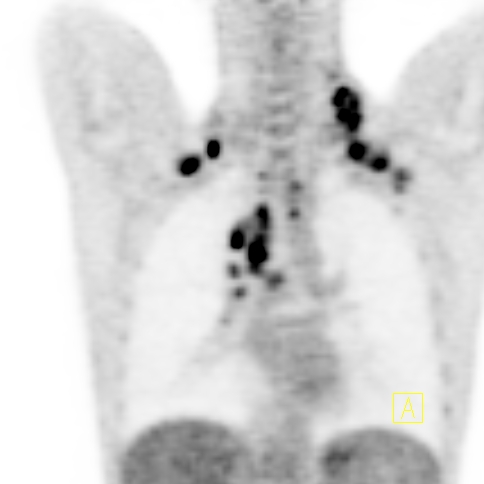 |
| B Badanie CT | 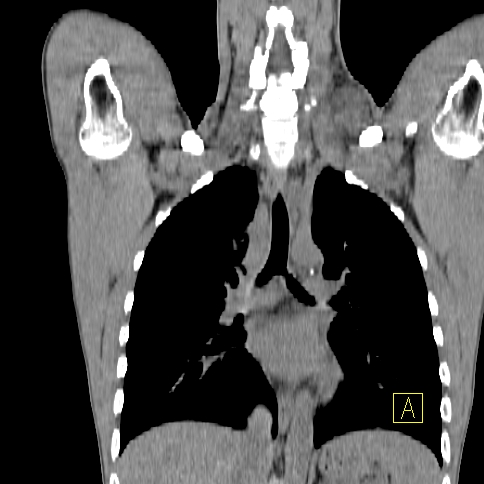 |
| C Fuzja PET/CT | 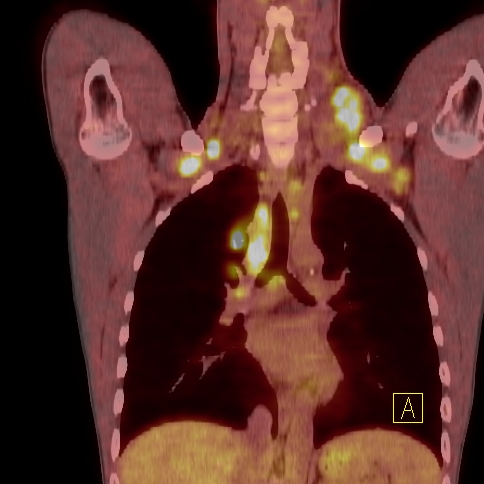 |
| RYC 2 Badanie PET/CT po podaniu 18 FDG u pacjenta po leczeniu operacyjnym i chemioterapii raka żołądka. Badanie wykonano w celu oceny charakteru stwierdzanej w badaniu CT zmiany w wątrobie. Widoczna jest aktywna metabolicznie zmiana w segmencie 3 wątroby, liczne aktywne metabolicznie węzły chłonne jamy brzusznej oraz zmiana w segmencie 6 płuca prawego |
|
| A Zmiana w wątrobie - Badanie PET | 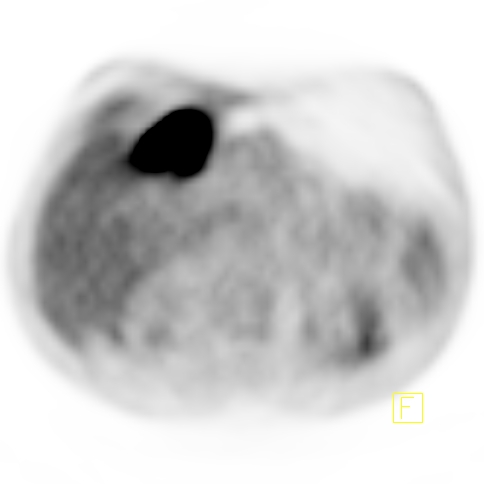 |
| B Zmiana w wątrobie - Badanie CT | 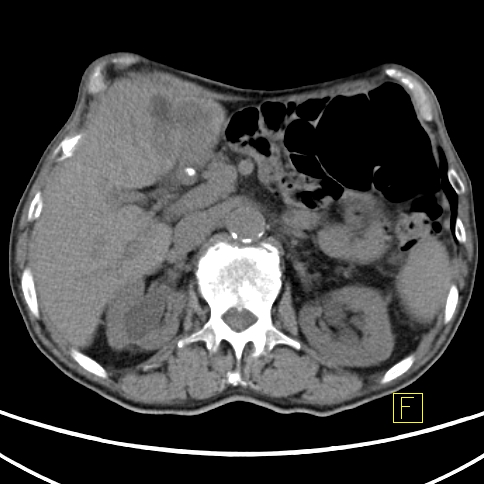 |
| C Zmiana w wątrobie - Fuzja PET/CT | 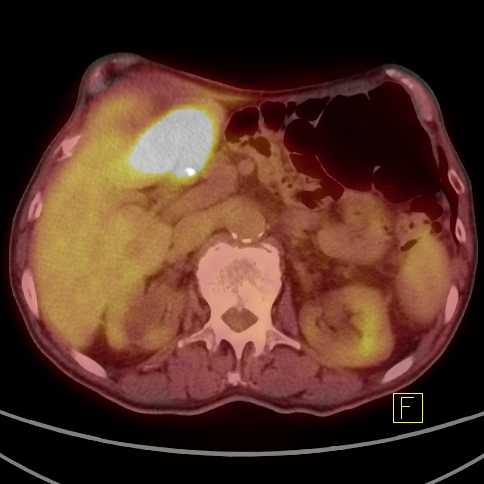 |
| D Węzły chłonne- Badanie PET |  |
| E Węzły chłonne- Badanie CT | 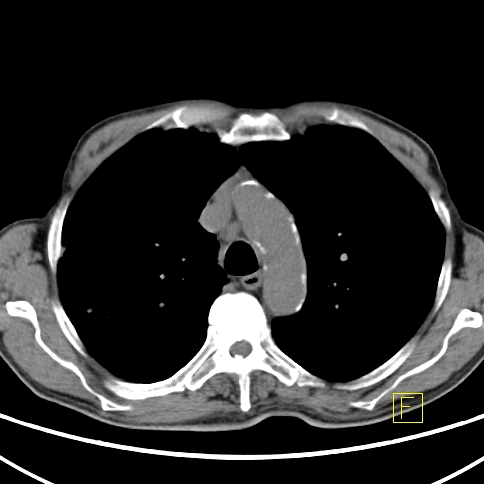 |
| F Węzły chłonne- Badanie PET/CT | 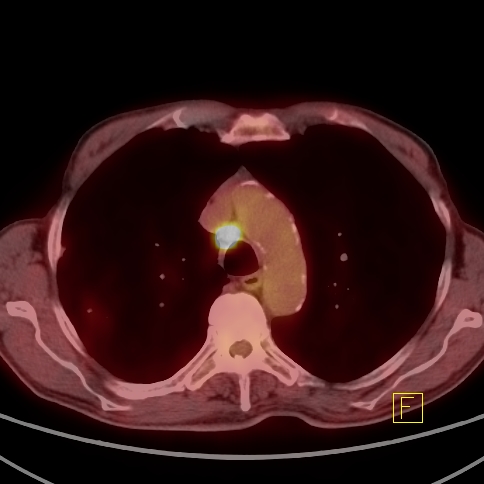 |
| G Zmiana w płucu prawym - Badanie PET | 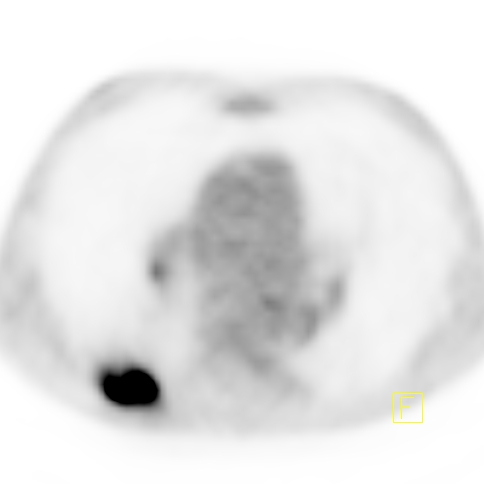 |
| H Zmiana w płucu prawym - Badanie CT | 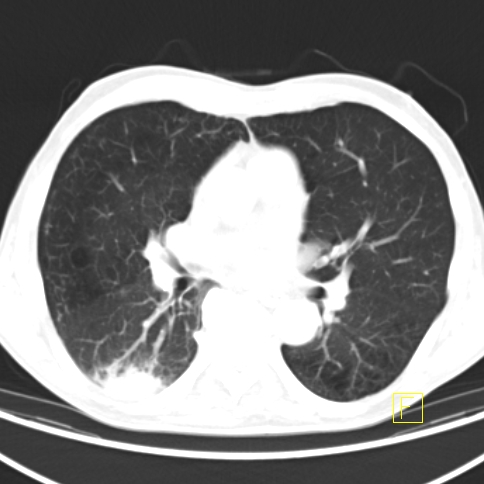 |
| I Zmiana w płucu prawym - Badanie PET/CT | 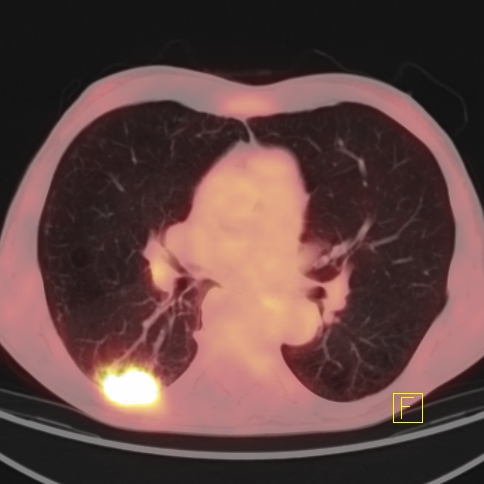 |
| RYC 3 Badanie PET/CT po podaniu 18 FDG u pacjentki ze zmianami w jajnikach. Badanie wykonano w celu oceny charakteru stwierdzanych zmian. Widoczne są aktywne metabolicznie zmiany w obu jajnikach |
|
| A Badanie PET |  |
| B Badanie CT | 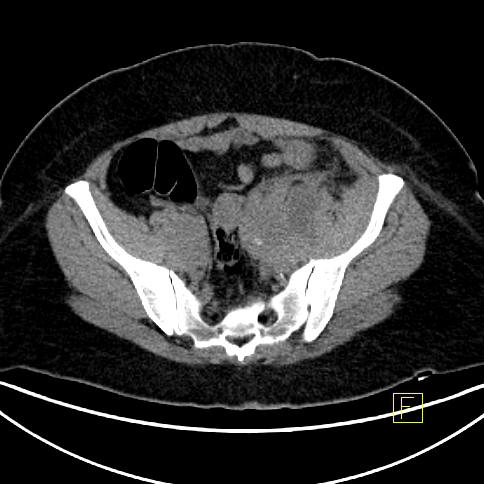 |
| C Fuzja PET/CT | 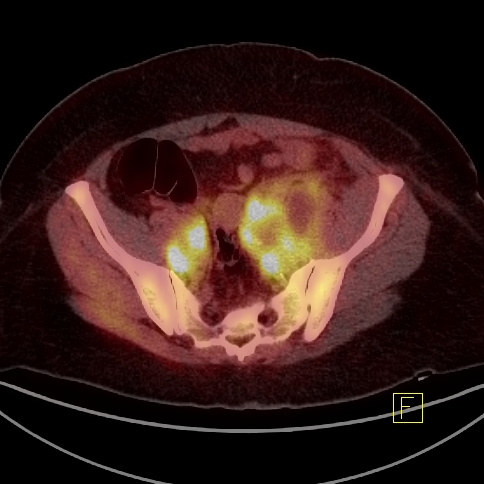 |
| RYC 4 Badanie PET/CT w kierunku obecności receptorów somatostatynowych po podaniu 68 Ga- DTATATE u pacjenta ze zmianą w trzustce Badanie wykonano w celu oceny stopnia zaawansowania. Widoczny jest guz trzustki z naciekiem krzywizny większej żołądka, przedniej wargi nerki lewej oraz przerzuty do wątroby ze zwiększoną ekspresją receptorową |
|
| A Zmiana w ogonie trzustki z naciekiem okolicznych tkanek- Badanie PET | 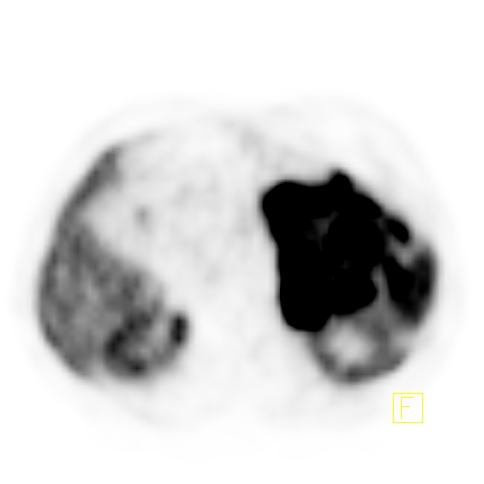 |
| B Zmiana w ogonie trzustki z naciekiem okolicznych tkanek - Badanie CT | 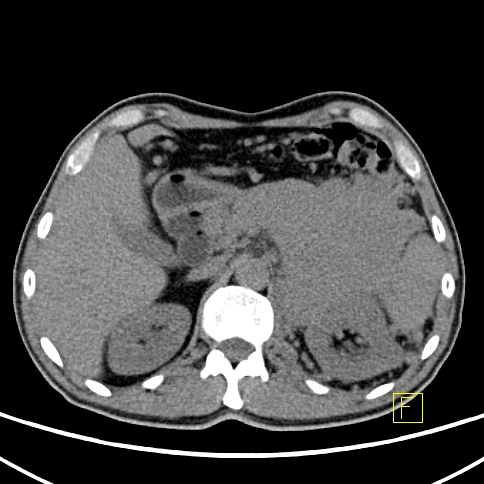 |
| C Zmiana w ogonie trzustki z naciekiem okolicznych tkanek - Fuzja PET/CT | 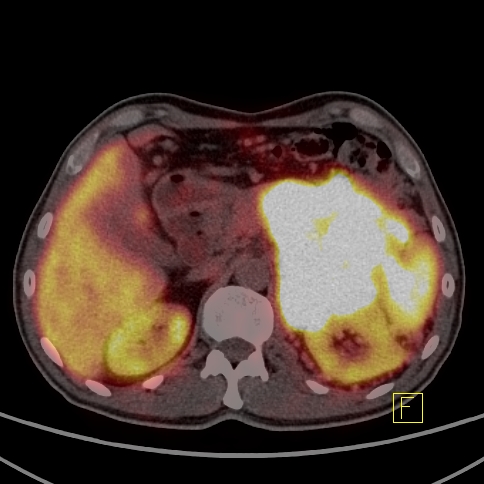 |
| D Przerzuty do wątroby - Badanie PET | 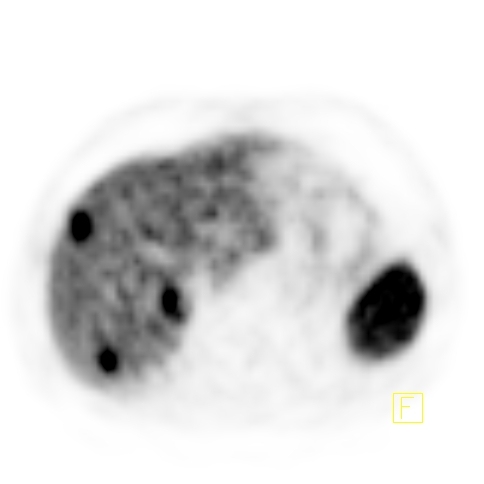 |
| E Przerzuty do wątroby - Badanie CT | 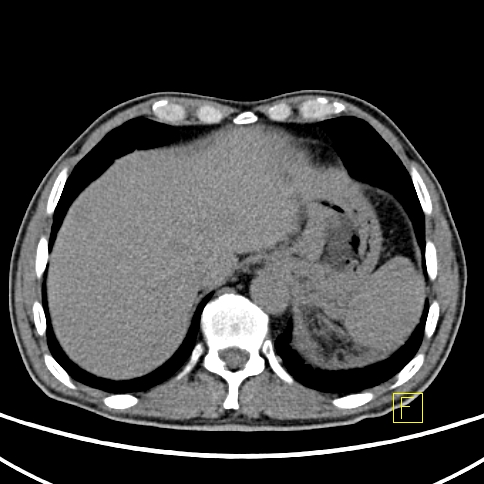 |
| F Przerzuty do wątroby - Badanie PET/CT | 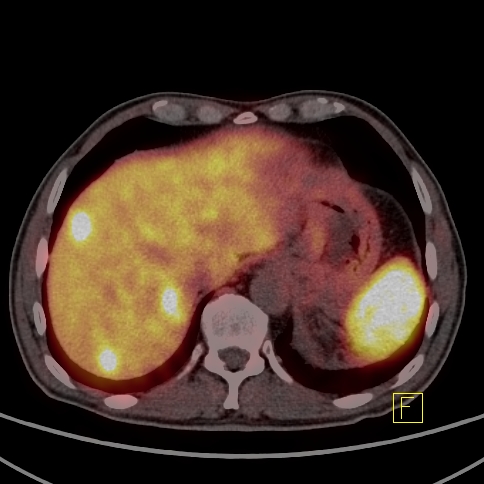 |
| RYC 5 Badanie PET/CT w kierunku obecności receptorów somatostatynowych po podaniu 68 Ga- DTATATE u pacjenta po usunięciu zmiany w trzustce przed 4 laty Badanie wykonano w celu oceny zmian stwierdzanych w badaniu CT w wątrobie. Widoczne są liczne rozsiane ogniska w wątrobie orazj pojedyncze ognisko w węźle chłonnym okołoaortalnym ze zwiększoną ekspresja receptorową |
|
| A. Przerzuty do wątroby - Badanie PET |  |
| B Przerzuty do wątroby - Badanie CT | 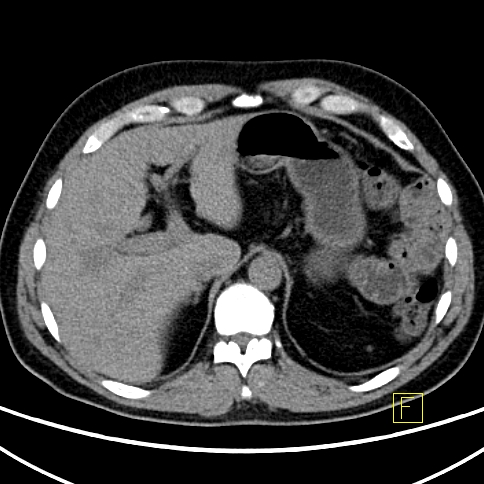 |
| C Przerzuty do wątroby - Fuzja PET/CT | 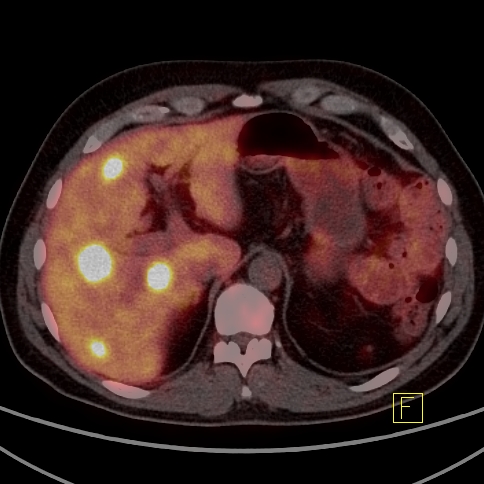 |
| D Węzeł chłonny okołoaortalny - Badanie PET |  |
| E Węzeł chłonny okołoaortalny - Badanie CT | 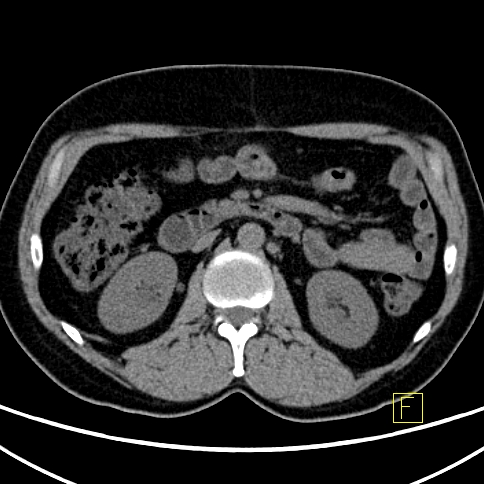 |
| F Węzeł chłonny okołoaortalny - Badanie PET/CT | |
| RYC 6 Badanie PET/CT w kierunku obecności receptorów somatostatynowych po podaniu 68 Ga- DTATATE u pacjentki po leczeniu operacyjnym raka neuroendokrynnego trzustki Badanie wykonano w celu oceny zmiany stwierdzonej w badaniu CT w kości krzyżowej. Widoczne są liczne rozsiane ogniska w wątrobie, żołądku na krzywiźnie większej, węźle chłonnym okołoaortalnym oraz w kości krzyżowej ze zwiększoną ekspresja receptorową |
|
| Badanie fuzyjne PET/CT A Zmiany w żołądku |
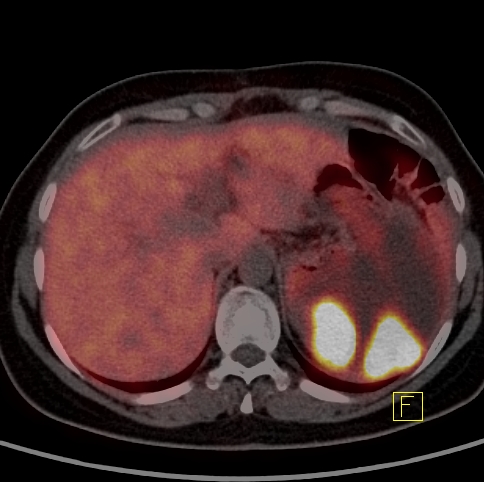 |
| B Zmiana w wątrobie | 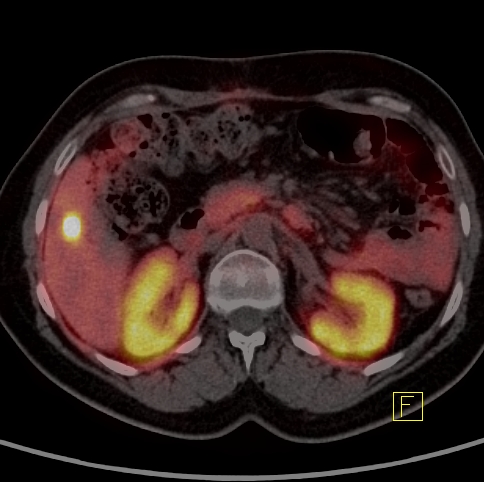 |
| C Zmiana w węźle chłonnym | 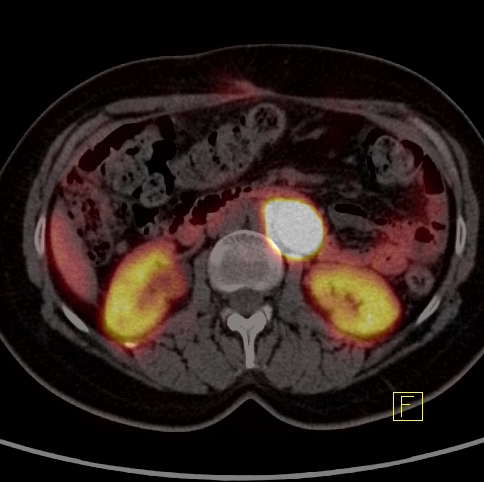 |
| D Zmiana w kości krzyżowej | 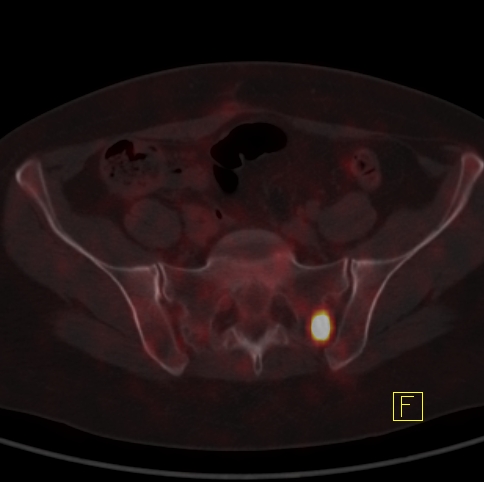 |
